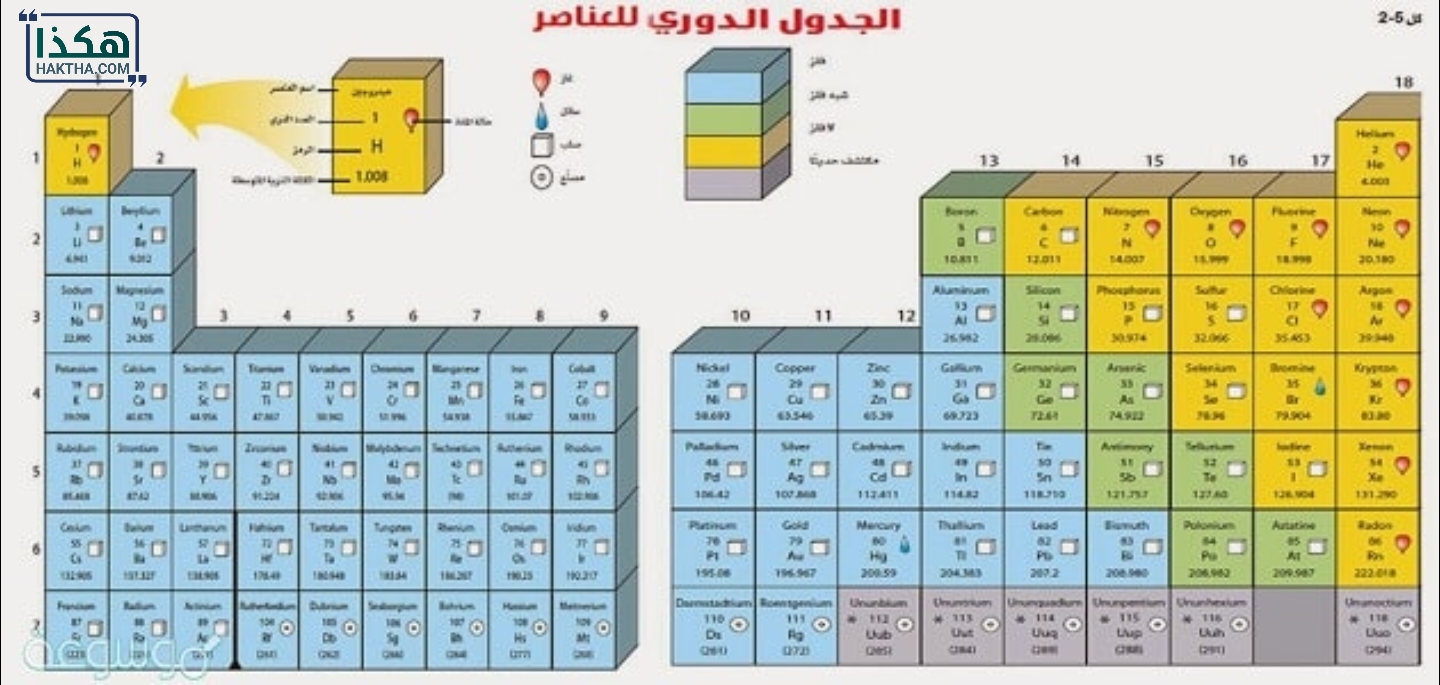
معظم العناصر الموجودة على يسار الجدول الدوري هي
معظم العناصر الموجودة على يسار الجدول الدوري هي معظم العناصر الموجودة على يسار الجدول الدوري هي العناصر المعدنية. تتميز العناصر المعدنية بكونها ذات صلابة عالية وقابلية للتوصيل الكهربائي والحراري. تشمل العناصر المعدنية الشائعة مثل الهيدروجين والليثيوم والصوديوم والبوتاسيوم والمغنيسيوم والكالسيوم والحديد والنحاس والزنك والفضة والذهب. إضافة إلى ذلك، يوجد العديد من العناصر الأخرى على يسار الجدول الدوري والتي تنتمي إلى مجموعات مختلفة، مثل الهالوجينات والغازات النبيلة والعناصر القلوية الأرضية.
الجدول الدوري
الجدول الدوري هو ترتيب نظامي للعناصر الكيميائية وفقًا لترتيبها النمطي وخصائصها الكيميائية. يتم تنظيم العناصر في الجدول الدوري بناءً على عدد وترتيب البروتونات في نواة ذراتها. يتم عرض العناصر في صفوف أفقية تسمى الدورات وأعمدة عمودية تسمى المجموعات.
الجدول الدوري يتكون من 18 مجموعة رئيسية ومجموعة فرعية تسمى الفترات. المجموعات تحتوي على العناصر التي تشترك في بعض الخصائص الكيميائية المشتركة، بينما الفترات تحدد عدد الطبقات الإلكترونية في الذرة.
الجدول الدوري يوفر معلومات مهمة حول العناصر الكيميائية، مثل الرمز الكيميائي، والكتلة الذرية، والتوزيع الإلكتروني، والخصائص الفيزيائية والكيميائية الأخرى. يساعد الجدول الدوري على تصنيف وفهم العناصر وعلاقاتها المشتركة واستخداماتها العديدة في العلوم الكيميائية والصناعات المختلفة.
معظم العناصر الموجودة على يسار الجدول الدوري هي
العناصر الموجودة على يسار الجدول الدوري هي العناصر المعدنية. تتميز العناصر المعدنية بكونها ذات صلابة عالية وقابلية للتوصيل الكهربائي والحراري. تشمل العناصر المعدنية الشائعة مثل الهيدروجين والليثيوم والصوديوم والبوتاسيوم والمغنيسيوم والكالسيوم والحديد والنحاس والزنك والفضة والذهب. إضافة إلى ذلك، يوجد العديد من العناصر الأخرى على يسار الجدول الدوري والتي تنتمي إلى مجموعات مختلفة، مثل الهالوجينات والغازات النبيلة والعناصر القلوية الأرضية.
خصائص الجدول الدوري
الجدول الدوري للعناصر يحتوي على العديد من الخصائص الهامة التي توفر معلومات حول العناصر الكيميائية. هنا بعض الخصائص الرئيسية للجدول الدوري:
- 1. الرمز الكيميائي:
- يُستخدم الرمز الكيميائي لتمثيل العنصر، وهو عبارة عن اختصار يتكون من حرفين أو ثلاثة حروف. على سبيل المثال، H للهيدروجين وO للأوكسجين.
- 2. العدد الذري:
- يُمثل العدد الذري عدد البروتونات في نواة الذرة، وهو الخاصية المميزة لكل عنصر. يتزايد العدد الذري من اليسار إلى اليمين في الجدول الدوري.
- 3. الكتلة الذرية:
- تُمثل الكتلة الذرية متوسط كتلة الذرات للعنصر، وتُعبر عنها بوحدة الكتلة الذرية (الأونصة الموحدة أو الجرام).
- 4. التوزيع الإلكتروني:
- يُعرض التوزيع الإلكتروني للعنصر في الجدول الدوري، ويوضح عدد الإلكترونات في كل طبقة إلكترونية.
- 5. المجموعات:
- يتم تقسيم العناصر في الجدول الدوري إلى مجموعات بناءً على تشابه خصائصها الكيميائية. تتميز المجموعات بأن لديها عدد مماثل من الإلكترونات في الطبقة الخارجية.
- 6. الفترات:
- تُشكل الفترات الأفقية في الجدول الدوري الصفوف، وتحدد عدد الطبقات الإلكترونية للعناصر.
- 7. الخصائص الكيميائية: يمكن استنتاج العديد من الخصائص الكيميائية للعناصر من موقعها في الجدول الدوري. على سبيل المثال، العناصر في نفس المجموعة تشترك في خصائص مشابهة مثل قابلية الانزلاق الكهربائي والخصائص الاكسدة.
هذه بعض الخصائص الرئيسية للجدول الدوري، وهناك العديد من الخصائص الأخرى التي يمكن استنتاجها وفهمها من الجدول الدوري للعناصر.
بالتأكيد! هنا بعض المعلومات الإضافية حول خصائص الجدول الدوري:
8. الخواص الفيزيائية: يمكن الحصول على بعض الأفكار حول الخواص الفيزيائية للعناصر من موقعها في الجدول الدوري. على سبيل المثال، العناصر في المجموعات اليمينية تكون غازات في درجة حرارة الغرفة، في حين تكون العناصر في المجموعات الوسطى صلبة، وتكون العناصر في المجموعات اليسارية معظمها فلزات قابلة للانصهار.
- 9. الكهرسلبية:
- تُعبر الكهرسلبية عن قدرة الذرة على جذب الإلكترونات. تزداد الكهرسلبية من اليسار إلى اليمين في الجدول الدوري، ومن الأسفل إلى الأعلى داخل المجموعات. العناصر ذات كهرسلبية عالية تميل إلى اكتساب الإلكترونات، في حين تميل العناصر ذات كهرسلبية منخفضة إلى فقدان الإلكترونات.
- 10. الاكتساب وفقدان الإلكترونات:
- يمكن توقع قدرة العناصر على اكتساب أو فقدان الإلكترونات من موقعها في الجدول الدوري. العناصر في المجموعات اليسارية تميل إلى التفاعل بشكل أكبر لفقدان الإلكترونات وتصبح أيونات موجبة، في حين تميل العناصر في المجموعات اليمنى إلى اكتساب الإلكترونات وتصبح أيونات سالبة.
- 11. النصف قطر الذري:
- يُمثل النصف قطر الذري نصف قطر الذرة، ويمكن استخدامه للمقارنة بين أحجام الذرات في الجدول الدوري. النصف قطر الذري ينخفض بشكل عام من اليسار إلى اليمين في الجدول الدوري، ويزيد عند الانتقال من الأعلى إلى الأسفل داخل المجموعات.
- 12. العناصر النادرة:
- توجد مجموعة من العناصر المعروفة باسم العناصر النادرة أو العناصر الثقيلة في الجدول الدوري. تتميز هذه العناصر بوجود عدد ذري عالي وكتلة ذرية كبيرة. تشمل العناصر النادرة الأشهر الأورانيوم والثوريوم والبلوتونيوم والكوريوم والكاليفورنيوم والأميريكيوم والكريليوم.
هذه بعض المعلومات الإضافية حول خصائص الجدول الدوري. يجب الإشارة إلى أن أن الجدول الدوري يحتوي على المزيد من البيانات والمعلومات حول العناصر الكيميائية، بما في ذلك خواص أخرى مثل نقطة الانصهار ونقطة الغليان والكثافة والتوصيل الحراري والكهربائي والخصائص المغناطيسية والتركيب البلوري والتوافق الكيميائي والاستخدامات الصناعية والطبية وغيرها. يمكن العثور على هذه البيانات في المصادر المرجعية المتعلقة بالكيمياء والعلوم الكيميائية.
في ختام هذا المنشور عبر موقع هكذا، يعد الجدول الدوري للعناصر أداة قيمة في الكيمياء والعلوم الكيميائية. يوفر معلومات مهمة حول الخصائص الكيميائية والفيزيائية للعناصر، ويساعد في فهم تركيب المادة وتفاعلاتها. يمكن استخدام الجدول الدوري للتنبؤ بخصائص العناصر المجهولة وتحديد العلاقات الكيميائية بين العناصر المختلفة. إن فهم الجدول الدوري يساعد العلماء والباحثين على استكشاف وفهم العالم المادي وتطوير تطبيقات جديدة في العديد من المجالات.
إذا كان لديك أي أسئلة أخرى حول الجدول الدوري أو أي موضوع آخر، فلا تتردد في طرحها. أنا هنا لمساعدتك!